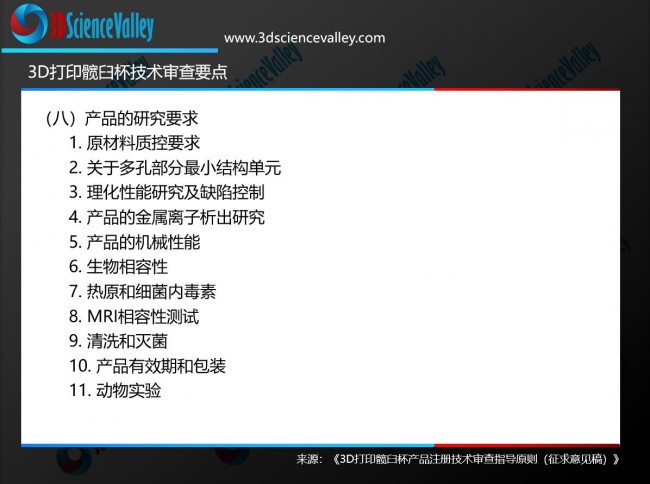
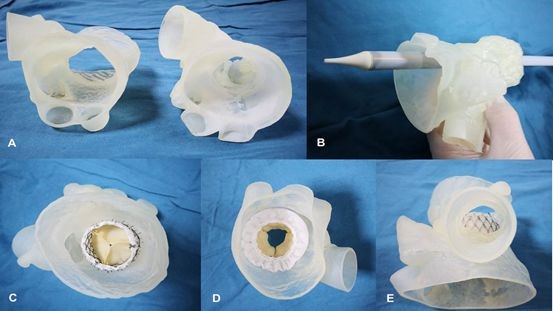
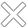3D打印髖臼杯是我國***早獲得醫療器械注冊證的金屬3D打印植入物產品。根據3D科學谷的市場研究,目前我國已有兩款通過國家藥品監督管理局(NMPA)審批,獲得醫療器械注冊證的國產化3D打印髖臼杯產品,包括:北京愛康宜誠醫療器材股份有限公司的髖關節假體 髖臼部件以及嘉思特華劍醫療器材(天津)有限公司生產的包括髖臼杯部件的骨小梁髖關節假體。
3D科學谷曾在《重磅 !又一國產3D打印骨科植入物通過國家藥監局審批》一文中對以上兩款3D打印髖臼杯產品所使用的材料、技術的進行了分析。
為規范3D打印髖臼杯產品的注冊申報和技術審評,提高技術審評工作效率,統一審評尺度,國家藥品監督管理局醫療器械技術審評中心組織起草了《3D打印髖臼杯產品注冊技術審查指導原則》,并在9月4日發布了指導原則的征求意見稿。
![]() 3D打印髖臼杯產業化已至
3D打印髖臼杯產業化已至
指導原則適用于人工髖關節置換用假體組件–3D打印髖臼外杯,通常采用TC4或TC4 ELI鈦合金粉末激光或者電子束熔融等增材制造工藝生產,但不包括對定制式髖臼外杯及缺損墊塊產品的要求。
接下來,指導原則對3D打印髖臼外杯植入物的技術審查要點做了詳細描述。

并在產品研發要求中對3D打印原材料、植入物中的多孔結構,增材制造植入物的化學成分、力學性能,植入物金屬離子析出,植入物產品的機械性能、生物相容性等方面進行了詳細描述。
產品的研究要求
在打印原材料質控要求中,指導原則指出,企業對于合金粉末材料應該提供詳細的材質單,包括粉末成分、粒度、粒徑分布、球形度、松裝密度、振實密度、流動性等,并應明確其所符合的標準。若原材料外購,需明確原材料供應商并附其資質證明文件、供銷關系證明文件(供銷協議)、質量標準及驗證報告。并且應對粉末可回收次數、篩分方法、新舊粉末混合比例(如適合)等進行規定,并提供粉末回收情況對打印過程和產品相關性能影響的驗證資料。
實現復雜、可控的多孔結構是粉末床金屬熔化3D打印技術在植入物制造領域得以應用的優勢之一,指導原則對于3D打印髖臼杯多孔部分也做了相應描述。指導原則指出,企業應提供產品打印***小結構單元的選擇和設定依據,如孔單元形態、孔徑大小及其分布、絲徑、孔隙率、平均孔隙截距、孔隙梯度、內部連通性、多孔結構的厚度等的質控范圍和確定依據。
此外,由于增材制造過程中,粉體經逐層堆疊、高能束加熱、快速凝固等過程,如工藝參數及后處理不當,產品較塑形加工材存在組織不均勻性及殘余應力等不利因素,可能引起產品的耐腐蝕性能下降,加之多孔結構表面積的增大,可能導致析出的合金元素離子濃度增高,指導原則對于金屬3D打印髖臼杯的金屬離子析出分析給出了指導。
指導原則建議針對產品的耐腐蝕性能及離子析出行為進行研究,應明確引用的標準、試驗方法、試驗介質、溫度等,并對其可接受性進行論證,應考量表面積大小、孔隙率、打印方向、位置、新舊粉末混合等因素對結果的影響,選取***差情況進行試驗。

產品生產制造相關要求
在3D打印髖臼杯的生產制造方面,指導原則對于增材制造軟件、設備和材料都提出了相應審批指導建議,例如:
-建議植入物制造企業論證患者影像數據采集、處理、傳輸、三維建模、性能預測(如力學分析)相關軟件的兼容性、容錯及可重復性、數據正確性和完整性,確保實現預期性能,明確所使用軟件名稱和版本號。當軟件需要更新及升級時,也必須進行再次確認。
-建議植入物制造企業建立完善的設備安全確認、操作確認、性能確認等制度,確保符合要求的設備在合格的環境中被正確的使用。
-建議植入物制造企業明確原材料和加工助劑的信息,包括材料或化學信息以及材料參數和包含測試方法的材料分析證書,建立對其原材料化學成分的檢驗方法。
國家藥品監督管理局醫療器械技術審評中心已開始針對《3D打印髖臼杯產品注冊技術審查指導原則》,向相關領域的專家、學者、管理者及從業人員征求意見或建議,從而推動指導原則的豐富和完善。意見或建議可通過反饋意見表,以電子郵件的形式,于2019年10月7日前反饋至國家藥品監督管理局醫療器械技術審評中心。
文章來源:3D科學谷









 合作交流
合作交流
 公眾號
公眾號